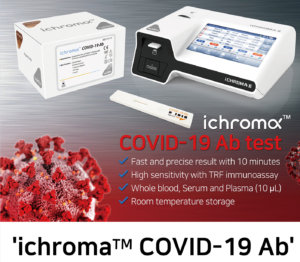
ichroma™ II COVID-19 Ab
Die Coronavirus-Krankheit 2019 (COVID-19) ist eine Infektionskrankheit, die durch das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2) verursacht wird. Die Krankheit wurde erstmals 2019 in Wuhan, China, festgestellt und hat sich seither weltweit ausgebreitet, was zur Coronavirus-Pandemie 2019-20 geführt hat.
Das SARS-CoV-2 (2019-nCOV) gehört zur Gattung der Betacoronaviren, zu der auch das Coronavirus des Schweren Akuten Respiratorischen Syndroms (SARS-CoV) und das Coronavirus des Respiratorischen Syndroms des Nahen Ostens (MERS-CoV) gehören.
Da die Krankheit zu lebensbedrohlicher Lungenentzündung und Multiorganversagen fortschreiten könnte, ist die Prävention und Kontrolle der Infektion sehr wichtig geworden. Da die Symptome nach dem Ausbruch der Krankheit in Ermangelung einer spezifischen Behandlung rasch schwer werden, ist eine frühe Diagnose der SARS-CoV-2-Infektion ganz entscheidend.
Der ichroma™ II COVID-19 Ab-Testsystem ist ein schneller in-vitro-diagnostischer Test zum qualitativen Nachweis von Anti-SARS-CoV-2 lgG/lgM-Antikörpern in Vollblut-, Serum- oder Plasmaproben mit hoher Sensitivität.
ichroma™ II COVID-19 Ab in Verbindung mit einem ichroma™ II Reader ist ein in-vitro-diagnostischer Fluoreszenz-Lmmunoassay zum qualitativen Nachweis und zur Differenzierung von lgG/lgM-Antikörpern gegen das neuartige Coronavirus SARS-CoV-2.
Typ der Probe
Vollblut/Serum/Plasma (10 µL)
Reaktionszeit
10 Min
Empfohlenes Antikoagulans
Na-Heparin Li-Heparin, K2 EDTA, Natriumzitrat
Interpretation des Ergebnisses
ichroma™ II COVID-19 Ab-Testergebnis
COVID-19 Ab lgM *COI Negativ oder lndeterminiert oder Positiv
COVID-19 Ab lgG *COI Negativ oder lndeterminiert oder Positiv
* Das Testergebnis ist negativ, wenn der COI < 0,9 ist, unbestimmt, wenn der COI 0,9-1,1 ist und positiv, wenn der COI >1,1-200 ist.
Analytische Empfindlichkeit
* Das ichroma™ II-System berechnet die jeweilige Anti-SARS-CoV-2-Antikörperkonzentration und zeigt schließlich das ichroma™ II COVID-19 Ab-Testergebnis qualitativ als ‚Negativ‘ oder ‚lndeterminiert‘ oder ‚Positiv‘ an, basierend auf vorprogrammierten analytischen mehrdeutigen Zonen und Cut-Offs, während es gleichzeitig das Testergebnis numerisch in Form des Cut-Off-Index (COI)-Wertes anzeigt
* Das Testergebnis ist negativ, wenn der Cut-Off-Index (COI) < 0,9 ist, unbestimmt, wenn der COI 0,9-1,1 ist und positiv, wenn der COI >1,1-200 ist.
* Der Cut-Off-Index von ichroma™ II COVID-19 Ab wurde anhand von 60 Proben bestimmt und validiert, die durch einen Molekulartest als negativ bestätigt wurden.
Analytische Spezifizität
* Kreuzreaktivität
Der ichroma™ II COVID-19 Ab-Test hat keine Kreuzreaktivität gezeigt, wenn klinische Proben von Patienten mit folgenden Infektionen und physiologischen Zuständen getestet wurden:
| Klinische Probe | Typ der Probe |
| Zytomegalie-Virus (CMV) | Positives Plasma |
| Epstein-Barr-Virus(EBV) | Positives Plasma |
| Hepatitis-A-Virus(HAV) | Positives Plasma |
| Hepatitis-C-Virus (HCV) | Positives Plasma |
| Hepatitis-B-Virus (HBV) | Positives Plasma |
| Herpes-simplex-Virus (HSV) | Positives Plasma |
| Röteln-Virus | Positives Plasma |
| Varizella-Zoster-Virus (VZV) | Positives Plasma |
| Treponema pallidum | Positives Plasma |
| Anti-Kern-Antikörper(ANA) | Positives Plasma |
| Rheuma-Faktor(RF) | Positives Plasma |
| Frühes Stadium der Schwangerschaft | Plasma |
| Mittleres Stadium der Schwangerschaft | Plasma |
| Hepatitis-B-Antikörper (Anti-HBs) | Hepatitis B Antikörper-Probe |
Keine Kreuzreaktivität mit „common cold coronavirus“ !
* Interferenz
Der ichroma™ II COVID-19 Ab-Test zeigte keine signifikanten Interferenzen, wenn Testproben mit folgenden endogenen Substanzen und Chemikalien in einer Konzentration getestet wurden, die viel höher war als ihr normaler physiologischer Wert im menschlichen Blut.
| Interferent | Interferenten-Konzentration getestet |
| Natrium-Heparin | 100,000 U/L |
| EDTA K2 | 2 mg/ml (5 µM) |
| Natriumzitrat | 25 mg/ml (0.085 µM) |
| Bilirubin | 0.3 mg/ml (500 µM) |
| Hämoglobin | 2 g/L |
| Triglyceride | 1.5 g/L |
| Cholesterin | 7.7 mg/ml (20 mM) |
| BSA | 30 g/L |
Klinische Leistungsbewertung
ichroma™ II COVID-19 Ab hat die folgenden klinischen Leistungsergebnisse gezeigt, als klinische Proben, die von verschiedenen asymptomatischen Personen und Patienten mit Verdacht auf COVID-19-Krankheit entnommen wurden, mit dem ichroma™ II COVID-19 Ab-Test getestet und durch Tests mit dem Allplex™ 2019-nCoV Assay bestätigt wurden (Seegene lnc., Südkorea)
| 2019-nCOV RT-PCR-Test | ||||
| Positiv | Negativ | Total | ||
| ichroma™ II
COVID-19 Ab |
Positiv | 46 | 0 | 46 |
| Negativ | 0 | 131 | 131 | |
| lndeterminiert | 2 | 4 | 6 | |
| Total | 48 | 135 | 183 | |
Klinische Sensitivität: 95,8%
Klinische Spezifität: 97,0%
EINSCHRÄNKUNGEN DES TESTSYSTEMS
Der Test kann aufgrund von Kreuzreaktionen und/oder unspezifischer Adhäsion bestimmter Komponenten der klinischen Proben an den Fänger-/Detektorantikörpern der Testkassette falsch positive Ergebnisse liefern.
Positive Ergebnisse können auch auf eine frühere oder gegenwärtige Infektion mit Nicht-SARS-CoV-2-Coronavirusstämmen, wie z.B. Coronavirus HKU1, NL63, OC43 oder 229E, zurückzuführen sein.
Der Test kann falsch negative Ergebnisse liefern. Eine Nichtansprechbarkeit des Antigens auf die Antikörper ist häufig, wenn das Epitop durch einige unbekannte Komponenten maskiert ist, so dass es von den Antikörpern nicht erkannt oder eingefangen werden kann.
Auch eine Instabilität oder ein Abbau des Antigens mit der Zeit und/oder Temperatur kann zu falsch negativen Ergebnissen führen, da das Antigen dadurch von den Antikörpern nicht erkannt werden kann.
Negative Ergebnisse schließen eine Infektion mit SARS-CoV-2 nicht aus, insbesondere nicht bei Personen, die mit dem Virus in Kontakt gekommen sind. Folgeuntersuchungen mit einem molekulardiagnostischen Test sollten in Betracht gezogen werden, um eine Infektion bei diesen Personen auszuschließen.
Andere Faktoren wie Technik-/Prozedurfehler, Abbau der Testkomponenten/Reagenzien, Vorhandensein von Störsubstanzen in den Proben usw. können zu falschen oder irreführenden Ergebnissen führen.
Ergebnisse von Antikörpertests sollten nicht als alleinige Grundlage für die Diagnose oder den Ausschluss einer SARS-CoV 2-Infektion oder zur Information über den Infektionsstatus verwendet werden.
ichroma™ II
Advanced compact immuno-analyzer
▶ QC & system check
▶ Multi-timer function
▶ Battery & AC operated
▶ LIS / HIS connectivity
ichroma™ II is an automatic or semiautomatic in-vitro diagnostic device that measures the concentration of analytes, contained in blood, urine, or other samples, in quantitative or semi-quantitative ways. Compared to the first generation device, ichroma™, ichroma™ II has an improved user interface and display and an advanced optical system, which provide the user with disease test options in wide range.
In addition, ichroma™ II was designed to improve data input efficiency and wireless communication connectivity through separately purchasable accessories and program update can be proceeded easily using SD card. The use of batteries improves portability, which is one of the biggest advantages of point-of-care testing (POCT) equipment, and ensures reliable testing in unstable power environments.
AFI AS-1
AS-1
Versatile Desktop immune-analyzer
▶ 1 channel
▶ LIS / HIS connectivity
▶ All-in-one cartridge
▶10, 30, and 50 µL Fingertip blood (C-Tip)
▶ Walk away function
▶ LIS ready (LAN/WiFi)
AFIAS platform is a fluorescence-scanning instrument to be used in conjunction with various AFIAS tests which are based on antigen-antibody reaction and fluorescence technology (Fluorescence Immuno-Assay). AFIAS uses a semiconductor diode laser as the excitation light source for illuminating the sample-loaded AFIAS cartridge(s) inserted in its cartridge slot(s); thereby triggering fluorescence from the fluorochrome-labeled complexes of analyte accumulated at the test line on the cartridge membrane. For some specified items such as TSH, CRP, PCT and HbA1c, small volume (10, 30 or 50uL) of whole blood from a finger or heel can be used for quantitative testing using a C-tip (capillary tip).
Brochure_all-the-products_Medica2016.pdf
ichroma™ CRP wins a ‘World Class Product of Korea Year 2015 award’ co-hosted by KOTRA & MOTIE.

“ichroma™ CRP marker has maintained its No. 1 market share in China thanks to its high quality and user-friendliness.
CRP (C-reactive protein) is a useful marker to evaluate patients for an acute or chronic inflammatory condition.
ichroma™ CRP test is performed on an ichroma analyzer, a fluorescence immune-assay instrument.
Since its global debut in 2005, the reagent along with the analyzer has been used at hospitals as well as doctor’s offices in over 80 countries.
The system can analyze over 30 different tests including inflammation, cardiovascular diseases, caners, diabetes, thyroid malfunction, etc.
Boditech Med Inc. will continue its investment into R&D in order to develop additional world-class in-vitro diagnostics products.”
MOTIE (Ministry of Trade, Industry and Energy) and KOTRA has hosted a “World Class Product of Korea Year 2015” award ceremony at COEX Grand Ballroom on Dec 16, 2015.
Amidst 300 attendees including a vice mister of MOTIE and a vice president of KOTRA, ichroma CRP was awarded as today’s world-class product of Korea 2015.
The award is granted to qualified Korean products that are either among global top 5 players or whose market share is over 5% worldwide.
MOTIE and KOTRA support the winners in a variety of aspects from R&D support to overseas marketing assistance.
Dr. Eui Yul Choi, CEO of Boditech Med Inc., has expressed his gratitude to MOFIE/KOTRA as well as his employees for the award.
And he also affirmed his relentless endeavor to present exemplary IVD products that can lead the global in-vitro diagnostics market as a IVD pioneer in Korea.

